व्यावहारिक कार्य। विषय: कार्बनिक पदार्थों की पहचान पर प्रयोगात्मक समस्याओं का समाधान प्रायोगिक पद्धति
कक्षा 891, 1ओवी क्रमांक 11665!
आई. वी. लेबेदेव, बी. ओ. ल्यूबिन और ए. ए. बननिकोवा
क्रिस्टल ग्लूकोज को अलग करने की विधि
इसके जल समाधान से
18 नवंबर, 1957 को काउंसिल आईएल के तहत आविष्कार और विघटन के लिए प्रथम कार्यालय में संख्या 586359 के तहत घोषित;.;:ps.por; सोवियत संघ
अध्ययनों से पता चला है कि ग्लूकोज के वजन के अनुसार 16 - 30/वोल्ट सोडियम क्लोराइड की उपस्थिति में, बाद वाला आसानी से NaCI में एक डबल यौगिक यौगिक (SvH120b) के रूप में अपने सुपरसैचुरेटेड समाधान से क्रिस्टलीकृत हो जाता है। एचबीओ, जो सुडौल और आसानी से गलने योग्य क्रिस्टल बनाता है।
दूसरी ओर, तीन-घटक प्रणाली ग्लूकोज - सोडियम क्लोराइड - पानी की समरूपता अवस्था का अध्ययन करने के परिणामस्वरूप, यह पाया गया कि निर्दिष्ट दोहरे यौगिक में अपघटन की निम्नलिखित दो तापमान श्रेणियां हैं। 28.5 से नीचे के तापमान पर, डबल यौगिक (जब कुछ निश्चित अनुपात में पानी के साथ मिलाया जाता है) ठोस चरण में हाइड्रेटेड ग्लूकोज क्रिस्टल की रिहाई के साथ अपने घटक घटकों में विघटित हो जाता है; इस मामले में, सभी सोडियम क्लोराइड और कुछ ग्लूकोज घोल में रहते हैं। 95.5 से ऊपर के तापमान पर, डबल यौगिक (जब कुछ निश्चित अनुपात में पानी के साथ मिलाया जाता है) ठोस चरण में सोडियम क्लोराइड क्रिस्टल की रिहाई के साथ अपने घटक घटकों में विघटित हो जाता है; इस मामले में, सभी ग्लूकोज और कुछ सोडियम क्लोराइड घोल में रहते हैं।
सोडियम क्लोराइड के साथ ग्लूकोज के दोहरे यौगिक के वर्णित गुणों को ध्यान में रखते हुए, दोहरे यौगिक के माध्यम से इसके जलीय घोल से क्रिस्टलीय ग्लूकोज को अलग करने के लिए निम्नलिखित विधि प्रस्तावित है: बाद वाले को 28.5 से नीचे के तापमान पर पानी के साथ विघटित किया जाता है, जारी ग्लूकोज क्रिस्टल होते हैं इंटरक्रिस्टलाइन तरल से अलग किया जाता है, जिसे तब 92.5 और उच्चतर पर दबाया जाता है जब तक कि सोडियम क्लोराइड क्रिस्टलीकृत न हो जाए, जिसके बाद बाद वाले को इंटरक्रिस्टलाइन घोल से अलग कर दिया जाता है, जो चक्र में वापस आ जाता है।
व्यवहार में, प्रस्तावित विधि को लगभग निम्नानुसार लागू किया जा सकता है।
सोडियम क्लोराइड की आवश्यक मात्रा को प्रारंभिक ग्लूकोज समाधान में पेश किया जाता है, उदाहरण के लिए, समाधान संख्या 116651 में मौजूद हाइड्रोक्लोरिक एसिड को सोडियम बेस के साथ बेअसर करके या टेबल नमक जोड़कर, और परिणामी समाधान को एक एकाग्रता में वाष्पित किया जाता है जो क्रिस्टलीकरण सुनिश्चित करता है दोहरा यौगिक. बाद के क्रिस्टलों को अंतरक्रिस्टलीय घोल से अलग किया जाता है और नीचे के तापमान पर पानी के साथ विघटित किया जाता है
28.5 और जारी क्रिस्टलीय ग्लूकोज को इंटरक्रिस्टलीय घोल से अलग किया जाता है। उत्तरार्द्ध में दोहरे यौगिक की संरचना की तुलना में सोडियम क्लोराइड की अधिक मात्रा होती है, जो इंटरक्रिस्टलाइन समाधान को एक निश्चित एकाग्रता में वाष्पित करके और उसके तापमान को 92.5 और उच्चतर तक लाकर जारी किया जाता है।
इस मामले में, घोल से केवल टेबल नमक के क्रिस्टल निकलते हैं, जो घोल से अलग हो जाते हैं। परिणामी निस्पंद को दोहरे यौगिक के क्रिस्टलीकरण के लिए या सीधे 28.5 से नीचे के तापमान पर ठंडा करके और आवश्यक मात्रा में पानी डालकर क्रिस्टलीय ग्लूकोज की रिहाई के साथ अपघटन के लिए भेजा जाता है।
मामले में जब प्रारंभिक ग्लूकोज समाधान में तैयार टेबल नमक जोड़ना आवश्यक होता है, तो डबल यौगिक के अपघटन से जल निकासी को वाष्पीकरण के लिए आपूर्ति किए गए ग्लूकोज समाधान के साथ आवश्यक अनुपात में मिलाया जाता है। और दोहरे यौगिक का क्रिस्टलीकरण।
इसके समाधानों से ग्लूकोज के सीधे क्रिस्टलीकरण की तुलना में, प्रस्तावित विधि के निम्नलिखित फायदे हैं। दोहरे यौगिक की उच्च क्रिस्टलीकरण क्षमता बहुत कम गुणवत्ता वाले समाधानों से ग्लूकोज के निष्कर्षण की अनुमति देती है, जिससे इसे सीधे क्रिस्टलीकरण द्वारा अलग नहीं किया जा सकता है, जिससे मूल समाधानों को शुद्ध करने की लागत कम हो जाती है। इसके अलावा, दोहरे कनेक्शन के माध्यम से ग्लूकोज जारी करने की प्रक्रिया प्रत्यक्ष क्रिस्टलीकरण की तुलना में कई गुना तेजी से आगे बढ़ती है और इसके लिए सख्त तापमान स्थितियों की आवश्यकता नहीं होती है, जो उपकरण के टुकड़ों की संख्या को कम करने की अनुमति देती है।
उदाहरण। सांद्र हाइड्रोक्लोरिक एसिड के साथ लकड़ी के हाइड्रोलिसिस द्वारा प्राप्त समाधानों से क्रिस्टलीय ग्लूकोज का अलगाव।
लकड़ी के हाइड्रोलिसिस की इस विधि का उपयोग करके ग्लूकोज उत्पादन के ज्ञात तरीकों के अनुसार, गैर-ग्लूकोज शर्करा (ज़ाइलोज़, मैनोज़, गैलेक्टोज़) को हटाने के लिए बाद के प्रारंभिक हाइड्रोलिसिस की आवश्यकता होती है जो ग्लूकोज के क्रिस्टलीकरण में हस्तक्षेप करते हैं। इसके अलावा, यह HC1 और अन्य अशुद्धियों की अवशिष्ट मात्रा को हटाने और उच्च गुणवत्ता वाले ग्लूकोज समाधान प्राप्त करने के लिए समाधानों के गहरे आयन एक्सचेंज शुद्धिकरण का उपयोग करता है।
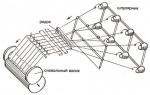
प्रस्तावित विधि के अनुसार, क्रिस्टलीय ग्लूकोज को अलग करने की प्रक्रिया निम्नलिखित योजनाबद्ध आरेख के अनुसार की जाती है, जिसके अनुसार सेलूलोज़ के प्रारंभिक हाइड्रोलिसिस और समाधानों के आयन-विनिमय शुद्धिकरण दोनों को बाहर रखा गया है। नं.ll665i
उलटा हाइड्रोलाइज़ेट
ग्यारह। (NaOH समाधान)
नैटलिवेशन
छानने का काम
बिजली चमकना
छानने का काम
न्यूट्रलाइज़ेशन का वैक्यूम बाष्पीकरणकर्ता एच
दोहरे यौगिक का क्रिस्टलीकरण (डीसी)
मैनुअल मैनुअल एलएस
बहिर्प्रवाह (हाइड्रोल)
क्रिस्टल डीएस,1, अपघटन डीएस (पानी)
मैनुअल मैनुअल
” “क्रिस्टलीय ग्लूकोज (सक्रिय कार्बन) ओटेक I.
92.5 से ऊपर तापमान पर वाष्पीकरण
क्रिस्टल के रूप में अतिरिक्त NaC1 का पृथक्करण
आउटटेक एन! (सी का ओटन! न्यूट्रलाइज़र के वैक्यूम वाष्पीकरण पर लौटता है) आविष्कार का विषय
सोडियम क्लोराइड के साथ एक डबल यौगिक के माध्यम से अपने जलीय घोल से क्रिस्टलीय ग्लूकोज को अलग करने की एक विधि, जिसमें कहा गया है कि डबल यौगिक को 28.5 से नीचे के तापमान पर पानी के साथ विघटित किया जाता है, जारी ग्लूकोज क्रिस्टल को इंटरक्रिस्टलाइन तरल से अलग किया जाता है, जिसे बाद में 92.5 पर वाष्पित किया जाता है। और ऊपर क्रिस्टलीय होने तक ".àöèè सोडियम क्लोराइड इंटरक्रिस्टलीय घोल से अलग हो जाता है, जो चक्र में वापस आ जाता है।
बिना लेबल वाली बोतलों में पाए जाने वाले पदार्थों की पहचान करने की गुणात्मक समस्याओं को हल करने में कई ऑपरेशन शामिल होते हैं, जिनके परिणामों का उपयोग यह निर्धारित करने के लिए किया जा सकता है कि किसी विशेष बोतल में कौन सा पदार्थ है।
समाधान का पहला चरण एक विचार प्रयोग है, जो एक कार्य योजना और उसके अपेक्षित परिणाम है। किसी विचार प्रयोग को रिकॉर्ड करने के लिए एक विशेष तालिका-मैट्रिक्स का उपयोग किया जाता है, जिसमें निर्धारित किए जा रहे पदार्थों के सूत्र क्षैतिज और लंबवत रूप से इंगित किए जाते हैं। उन स्थानों पर जहां परस्पर क्रिया करने वाले पदार्थों के सूत्र प्रतिच्छेद करते हैं, अवलोकनों के अपेक्षित परिणाम दर्ज किए जाते हैं: - गैस विकास, - वर्षा, रंग, गंध में परिवर्तन या दृश्य परिवर्तनों की अनुपस्थिति का संकेत दिया जाता है। यदि, समस्या की स्थितियों के अनुसार, अतिरिक्त अभिकर्मकों का उपयोग करना संभव है, तो तालिका संकलित करने से पहले उनके उपयोग के परिणामों को लिखना बेहतर है - इस प्रकार तालिका में निर्धारित किए जाने वाले पदार्थों की संख्या को कम किया जा सकता है।
इसलिए समस्या के समाधान में निम्नलिखित चरण शामिल होंगे:
- व्यक्तिगत प्रतिक्रियाओं और पदार्थों की बाहरी विशेषताओं की प्रारंभिक चर्चा;
- एक तालिका में जोड़ीवार प्रतिक्रियाओं के सूत्रों और अपेक्षित परिणामों को रिकॉर्ड करना,
- तालिका के अनुसार एक प्रयोग करना (प्रायोगिक कार्य के मामले में);
- प्रतिक्रिया परिणामों का विश्लेषण और उन्हें विशिष्ट पदार्थों के साथ सहसंबंधित करना;
- समस्या का उत्तर तैयार करना।
इस बात पर जोर दिया जाना चाहिए कि एक विचार प्रयोग और वास्तविकता हमेशा पूरी तरह से मेल नहीं खाती है, क्योंकि वास्तविक प्रतिक्रियाएं कुछ सांद्रता, तापमान और प्रकाश व्यवस्था पर होती हैं (उदाहरण के लिए, विद्युत प्रकाश के तहत, AgCl और AgBr समान हैं)। एक सोचा हुआ प्रयोग अक्सर कई छोटी-छोटी बातें छोड़ देता है। उदाहरण के लिए, Br 2 /aq को Na 2 CO 3, Na 2 SiO 3, CH 3 COONa के घोल से पूरी तरह से रंगहीन कर दिया जाता है; Ag 3 PO 4 अवक्षेप का निर्माण अत्यधिक अम्लीय वातावरण में नहीं होता है, क्योंकि एसिड स्वयं यह प्रतिक्रिया नहीं देता है; ग्लिसरॉल Cu (OH) 2 के साथ एक कॉम्प्लेक्स बनाता है, लेकिन (CuOH) 2 SO 4 के साथ नहीं बनता है, यदि कोई अतिरिक्त क्षार आदि न हो। वास्तविक स्थिति हमेशा सैद्धांतिक भविष्यवाणी से सहमत नहीं होती है, और इस अध्याय में हैं "आदर्श" मैट्रिक्स तालिकाएँ और "वास्तविकताएँ" कभी-कभी भिन्न होंगी। और यह समझने के लिए कि वास्तव में क्या हो रहा है, किसी पाठ या ऐच्छिक में प्रयोगात्मक रूप से अपने हाथों से काम करने के हर अवसर की तलाश करें (सुरक्षा आवश्यकताओं को याद रखें)।
उदाहरण 1।क्रमांकित बोतलों में निम्नलिखित पदार्थों के घोल होते हैं: सिल्वर नाइट्रेट, हाइड्रोक्लोरिक एसिड, सिल्वर सल्फेट, लेड नाइट्रेट, अमोनिया और सोडियम हाइड्रॉक्साइड। अन्य अभिकर्मकों का उपयोग किए बिना, यह निर्धारित करें कि किस बोतल में किस पदार्थ का घोल है।
समाधान।समस्या को हल करने के लिए, हम एक मैट्रिक्स तालिका बनाएंगे जिसमें हम इसे प्रतिच्छेद करने वाले विकर्ण के नीचे उपयुक्त वर्गों में एक परीक्षण ट्यूब से दूसरे के साथ पदार्थों के विलय के परिणामों का अवलोकन डेटा दर्ज करेंगे।
कुछ क्रमांकित परखनलियों की सामग्री को अन्य सभी में क्रमिक रूप से डालने के परिणामों का अवलोकन:
1 + 2 - एक सफेद अवक्षेप बनता है; ;
1 + 3 - कोई दृश्यमान परिवर्तन नहीं देखा गया;
| पदार्थों | 1. एग्नो 3, | 2. एचसीएल | 3. पीबी(NO 3) 2, | 4.NH4OH | 5.NaOH |
| 1. AgNO3 | एक्स | एजीसीएल सफेद | - | जो अवक्षेप गिरता है वह घुल जाता है | एजी 2 ओ भूरा |
| 2. एचसीएल | सफ़ेद | एक्स | पीबीसीएल 2 सफेद, | - | _ |
| 3. Pb(NO 3) 2 | - | सफ़ेद PbCl 2 | एक्स | Pb(OH) 2 मैलापन) | पीबी(ओएच) 2 सफेद |
| 4.NH4OH | - | - | (मैलापन) | - | |
| S.NaOH | भूरा | - | सफ़ेद | - | एक्स |
1 + 4 - घोल के निकास के क्रम के आधार पर, एक अवक्षेप बन सकता है;
1 + 5 - एक भूरा अवक्षेप बनता है;
2+3 - एक सफेद अवक्षेप बनता है;
2+4 - कोई दृश्यमान परिवर्तन नहीं देखा गया;
2+5 - कोई दृश्यमान परिवर्तन नहीं देखा गया;
3+4 - बादल छाए हुए हैं;
3+5 - एक सफेद अवक्षेप बनता है;
4+5 - कोई दृश्यमान परिवर्तन नहीं देखा गया।
आइए हम उन मामलों में चल रही प्रतिक्रियाओं के समीकरणों को लिखें जहां प्रतिक्रिया प्रणाली (गैस का उत्सर्जन, तलछट, रंग परिवर्तन) में परिवर्तन देखा जाता है और देखे गए पदार्थ के सूत्र और विकर्ण के ऊपर मैट्रिक्स तालिका के संबंधित वर्ग को दर्ज करें जो इसे काटता है:
| I. 1+2: | एग्नो 3 + एचसीएल | एजीसीएल + एचएनओ 3; | |
| द्वितीय. 1+5: | 2AgNO3 + 2NaOH | Ag 2 O + 2NaNO 3 + H 2 O; | |
| भूरा (2AgOH Ag 2 O + H 2 O) | |||
| तृतीय. 2+3: | 2HCl + Pb(NO 3) 2 | PbCl 2 + 2HNO 3; | |
| सफ़ेद | |||
| चतुर्थ. 3+4: | Pb(NO 3) 2 + 2NH 4 OH | Pb(OH) 2 + 2NH 4 NO 3 ; | |
| बादल | |||
| वी.3+5: | Pb(NO 3) 2 + 2NaOH | Pb(OH) 2 + 2NaNO 3 | |
| सफ़ेद |
(जब लेड नाइट्रेट को अतिरिक्त क्षार में मिलाया जाता है, तो अवक्षेप तुरंत घुल सकता है)।
इस प्रकार, पाँच प्रयोगों के आधार पर, हम क्रमांकित परीक्षण ट्यूबों में पदार्थों को अलग करते हैं।
उदाहरण 2. बिना शिलालेख वाली आठ क्रमांकित परखनलियों (1 से 8 तक) में शुष्क पदार्थ होते हैं: सिल्वर नाइट्रेट (1), एल्यूमीनियम क्लोराइड (2), सोडियम सल्फाइड (3), बेरियम क्लोराइड (4), पोटेशियम नाइट्रेट (5), फॉस्फेट पोटेशियम (6), साथ ही सल्फ्यूरिक (7) और हाइड्रोक्लोरिक (8) एसिड के समाधान। पानी के अलावा किसी भी अतिरिक्त अभिकर्मक के बिना, आप इन पदार्थों के बीच अंतर कैसे कर सकते हैं?
समाधान। सबसे पहले, आइए ठोस पदार्थों को पानी में घोलें और परखनलियों को चिह्नित करें जहां वे समाप्त हुए। आइए एक मैट्रिक्स तालिका बनाएं (जैसा कि पिछले उदाहरण में है), जिसमें हम एक टेस्ट ट्यूब से दूसरे टेस्ट ट्यूब के साथ पदार्थों के विलय के परिणामों के अवलोकन से उस विकर्ण के नीचे और ऊपर डेटा दर्ज करेंगे जो इसे काटता है। तालिका के दाईं ओर हम एक अतिरिक्त कॉलम "अवलोकन का सामान्य परिणाम" पेश करेंगे, जिसे हम सभी प्रयोगों को पूरा करने और अवलोकन के परिणामों को बाएं से दाएं क्षैतिज रूप से सारांशित करने के बाद भरेंगे (उदाहरण के लिए, पृष्ठ 178 देखें) ).
| 1+2: | 3AgNO3 + A1C1, | 3AgCl सफेद | + अल(NO 3) 3 ; | |
| 1 + 3: | 2AgNO3 + Na2S | एजी 2 एस काला | + 2NaNO 3 ; | |
| 1 + 4: | 2AgNO3 + BaCl2 | 2AgCl सफेद | + बा(NO 3) 2 ; | |
| 1 + 6: | 3AgN0 3 + K 3 PO 4 | एजी 3 पीओ 4 पीला | + 3KNO 3 ; | |
| 1 + 7: | 2AgNO3 + H2SO4 | एजी,एसओ 4 सफेद | + 2HNO एस; | |
| 1 + 8: | AgNO3 + HCl | एजीसीएल सफेद | + HNO3; | |
| 2 + 3: | 2AlCl 3 + 3Na 2 S + 6H 2 O | 2Al(OH)3, | + 3H 2 S + 6NaCl; | |
| (Na 2 S + H 2 O NaOH + NaHS, हाइड्रोलिसिस); | ||||
| 2 + 6: | एएलसीएल 3 + के 3 पीओ 4 | A1PO 4 सफेद | + 3KCl; | |
| 3 + 7: | ना 2 एस + एच 2 एसओ 4 | Na2SO4 | +H2S | |
| 3 + 8: | Na 2 S + 2HCl | -2NaCl | + एच 2 एस; | |
| 4 + 6: | 3BaCl2 + 2K3PO4 | बा 3 (पीओ 4) 2 सफेद | + 6केसी1; | |
| 4 + 7 | BaCl 2 + H 2 SO 4 | BaSO4 सफेद | + 2HC1. | |
दृश्य परिवर्तन केवल पोटेशियम नाइट्रेट के साथ नहीं होते हैं।
अवक्षेप बनने और गैस निकलने की संख्या के आधार पर, सभी अभिकर्मकों की विशिष्ट पहचान की जाती है। इसके अलावा, BaCl 2 और K 3 PO 4 को AgNO 3 के साथ अवक्षेप के रंग से अलग किया जाता है: AgCl सफेद है, और Ag 3 PO 4 पीला है। इस समस्या में, समाधान सरल हो सकता है - कोई भी एसिड समाधान आपको सोडियम सल्फाइड को तुरंत अलग करने की अनुमति देता है, जो सिल्वर नाइट्रेट और एल्यूमीनियम क्लोराइड को निर्धारित करता है। शेष तीन ठोस पदार्थों में, बेरियम क्लोराइड और पोटेशियम फॉस्फेट सिल्वर नाइट्रेट द्वारा निर्धारित होते हैं; हाइड्रोक्लोरिक और सल्फ्यूरिक एसिड बेरियम क्लोराइड द्वारा प्रतिष्ठित होते हैं।
उदाहरण 3. चार बिना लेबल वाली टेस्ट ट्यूबों में बेंजीन, क्लोरहेक्सेन, हेक्सेन और हेक्सेन हैं। अभिकर्मकों की न्यूनतम मात्रा और संख्या का उपयोग करते हुए, प्रत्येक निर्दिष्ट पदार्थ को निर्धारित करने के लिए एक विधि प्रस्तावित करें।
समाधान। निर्धारित किए जा रहे पदार्थ एक-दूसरे के साथ प्रतिक्रिया नहीं करते हैं; जोड़ीवार प्रतिक्रियाओं की तालिका संकलित करने का कोई मतलब नहीं है।
इन पदार्थों को निर्धारित करने की कई विधियाँ हैं, उनमें से एक नीचे दी गई है।
केवल हेक्सिन ब्रोमीन पानी का रंग तुरंत ख़राब कर देता है:
सी 6 एच 12 + बीआर 2 = सी 6 एच 12 बीआर 2।
क्लोरहेक्सेन को उनके दहन उत्पादों को सिल्वर नाइट्रेट के घोल से गुजारकर हेक्सेन से अलग किया जा सकता है (क्लोरहेक्सेन के मामले में, सिल्वर क्लोराइड अवक्षेप का एक सफेद अवक्षेप, सिल्वर कार्बोनेट के विपरीत, नाइट्रिक एसिड में अघुलनशील होता है):
2सी 6 एच 14 + 19ओ 2 = 12सीओ 2 + 14एच 2 ओ;
सी 6 एच 13 सीएल + 9ओ 2 = 6 सीओ 2 + 6 एच 2 ओ + एचसी1;
एचसीएल + एग्नो 3 = एजीसीएल + एचएनओ 3।
बेंजीन बर्फ के पानी में जमने में हेक्सेन से भिन्न होता है (सी 6 एच का गलनांक 6 = +5.5 डिग्री सेल्सियस है, और सी 6 एच का गलनांक 14 = -95.3 डिग्री सेल्सियस है)।
1. समान मात्रा में दो समान बीकरों में डाला जाता है: एक पानी का, दूसरा सल्फ्यूरिक एसिड का पतला घोल। बिना किसी रासायनिक अभिकर्मक (आप घोल का स्वाद नहीं चख सकते) के बिना आप इन तरल पदार्थों के बीच अंतर कैसे कर सकते हैं?
2. चार टेस्ट ट्यूबों में कॉपर (II) ऑक्साइड, आयरन (III) ऑक्साइड, सिल्वर और आयरन के पाउडर होते हैं। केवल एक रासायनिक अभिकर्मक का उपयोग करके इन पदार्थों को कैसे पहचाना जाए? दिखावे से पहचान को बाहर रखा गया है।
3. चार क्रमांकित परीक्षण ट्यूबों में सूखा कॉपर (II) ऑक्साइड, कार्बन ब्लैक, सोडियम क्लोराइड और बेरियम क्लोराइड होता है। अभिकर्मकों की न्यूनतम मात्रा का उपयोग करके, आप यह कैसे निर्धारित कर सकते हैं कि किस टेस्ट ट्यूब में कौन सा पदार्थ है? अपने उत्तर का औचित्य सिद्ध करें और संबंधित रासायनिक प्रतिक्रियाओं के समीकरणों से इसकी पुष्टि करें।
4. छह बिना लेबल वाले परीक्षण ट्यूबों में निर्जल यौगिक होते हैं: फॉस्फोरस (वी) ऑक्साइड, सोडियम क्लोराइड, कॉपर सल्फेट, एल्यूमिनियम क्लोराइड, एल्यूमिनियम सल्फाइड, अमोनियम क्लोराइड। यदि आपके पास खाली टेस्ट ट्यूब, पानी और बर्नर का एक सेट है तो आप प्रत्येक टेस्ट ट्यूब की सामग्री कैसे निर्धारित कर सकते हैं? एक विश्लेषण योजना प्रस्तावित करें.
5 . चार अचिह्नित परीक्षण ट्यूबों में सोडियम हाइड्रॉक्साइड, हाइड्रोक्लोरिक एसिड, पोटाश और एल्यूमीनियम सल्फेट के जलीय घोल होते हैं। अतिरिक्त अभिकर्मकों का उपयोग किए बिना प्रत्येक टेस्ट ट्यूब की सामग्री निर्धारित करने का एक तरीका सुझाएं।
6 . क्रमांकित परीक्षण ट्यूबों में सोडियम हाइड्रॉक्साइड, सल्फ्यूरिक एसिड, सोडियम सल्फेट और फिनोलफथेलिन के समाधान होते हैं। अतिरिक्त अभिकर्मकों का उपयोग किए बिना इन समाधानों के बीच अंतर कैसे करें?
7. बिना लेबल वाले जार में निम्नलिखित व्यक्तिगत पदार्थ होते हैं: लौह, जस्ता, कैल्शियम कार्बोनेट, पोटेशियम कार्बोनेट, सोडियम सल्फेट, सोडियम क्लोराइड, सोडियम नाइट्रेट के पाउडर, साथ ही सोडियम हाइड्रॉक्साइड और बेरियम हाइड्रॉक्साइड के समाधान। आपके पास पानी सहित कोई अन्य रासायनिक अभिकर्मक नहीं है। प्रत्येक जार की सामग्री निर्धारित करने के लिए एक योजना बनाएं।
8 . बिना लेबल वाले चार क्रमांकित जार में ठोस फॉस्फोरस (वी) ऑक्साइड (1), कैल्शियम ऑक्साइड (2), लेड नाइट्रेट (3), कैल्शियम क्लोराइड (4) होते हैं। निर्धारित करें कि किस जार में प्रत्येक शामिल है सेसंकेतित यौगिकों में से, यदि यह ज्ञात है कि पदार्थ (1) और (2) पानी के साथ हिंसक रूप से प्रतिक्रिया करते हैं, और पदार्थ (3) और (4) पानी में घुल जाते हैं, और परिणामी समाधान (1) और (3) के साथ प्रतिक्रिया कर सकते हैं वर्षा के निर्माण के साथ अन्य सभी समाधान।
9 . बिना लेबल वाली पांच टेस्ट ट्यूबों में हाइड्रॉक्साइड, सल्फाइड, क्लोराइड, सोडियम आयोडाइड और अमोनिया के घोल होते हैं। एक अतिरिक्त अभिकर्मक का उपयोग करके इन पदार्थों का निर्धारण कैसे करें? रासायनिक अभिक्रियाओं के लिए समीकरण दीजिए।
10. केवल इन समाधानों का उपयोग करके बिना लेबल वाले बर्तनों में मौजूद सोडियम क्लोराइड, अमोनियम क्लोराइड, बेरियम हाइड्रॉक्साइड, सोडियम हाइड्रॉक्साइड के समाधानों को कैसे पहचानें?
11. . आठ क्रमांकित परीक्षण ट्यूबों में हाइड्रोक्लोरिक एसिड, सोडियम हाइड्रॉक्साइड, सोडियम सल्फेट, सोडियम कार्बोनेट, अमोनियम क्लोराइड, लेड नाइट्रेट, बेरियम क्लोराइड और सिल्वर नाइट्रेट के जलीय घोल होते हैं। संकेतक पेपर का उपयोग करके और परीक्षण ट्यूबों में समाधानों के बीच कोई प्रतिक्रिया करते हुए, यह निर्धारित करें कि उनमें से प्रत्येक में कौन सा पदार्थ शामिल है।
12. दो परीक्षण ट्यूबों में सोडियम हाइड्रॉक्साइड और एल्यूमीनियम सल्फेट के घोल होते हैं। यदि संभव हो तो, अतिरिक्त पदार्थों के उपयोग के बिना, केवल एक खाली टेस्ट ट्यूब होने पर या इसके बिना भी, उन्हें कैसे अलग किया जाए?
13. पाँच क्रमांकित परीक्षण ट्यूबों में पोटेशियम परमैंगनेट, सोडियम सल्फाइड, ब्रोमीन पानी, टोल्यूनि और बेंजीन के घोल होते हैं। आप केवल नामित अभिकर्मकों का उपयोग करके उनके बीच अंतर कैसे कर सकते हैं? पांच पदार्थों में से प्रत्येक का पता लगाने के लिए उनकी विशिष्ट विशेषताओं का उपयोग करें (उन्हें इंगित करें); विश्लेषण के लिए एक योजना दीजिए. आवश्यक प्रतिक्रियाओं के चित्र लिखिए।
14. छह अनाम बोतलों में ग्लिसरीन, ग्लूकोज का एक जलीय घोल, ब्यूटिराल्डिहाइड (ब्यूटेनल), 1-हेक्सिन, सोडियम एसीटेट का एक जलीय घोल और 1,2-डाइक्लोरोइथेन होता है। अतिरिक्त रसायनों के रूप में केवल निर्जल सोडियम हाइड्रॉक्साइड और कॉपर सल्फेट के साथ, निर्धारित करें कि प्रत्येक बोतल में क्या है।
1. पानी और सल्फ्यूरिक एसिड का निर्धारण करने के लिए, आप भौतिक गुणों में अंतर का उपयोग कर सकते हैं: क्वथनांक और हिमांक, घनत्व, विद्युत चालकता, अपवर्तक सूचकांक, आदि। सबसे मजबूत अंतर विद्युत चालकता में होगा।
2.
टेस्ट ट्यूब में पाउडर में हाइड्रोक्लोरिक एसिड मिलाएं। चाँदी प्रतिक्रिया नहीं करेगी. जब लोहा घुलता है, तो गैस निकलेगी: Fe + 2HCl = FeCl 2 + H 2
आयरन (III) ऑक्साइड और कॉपर (II) ऑक्साइड बिना गैस छोड़े घुल जाते हैं, जिससे पीला-भूरा और नीला-हरा घोल बनता है: Fe 2 O 3 + 6HCl = 2FeCl 3 + 3H 2 O; CuO + 2HCl = CuCl 2 + H 2 O.
3. CuO और C काले हैं, NaCl और BaBr 2 सफेद हैं। एकमात्र अभिकर्मक, उदाहरण के लिए, तनु सल्फ्यूरिक एसिड H2SO4 हो सकता है:
CuO + H 2 SO 4 = CuSO 4 + H 2 O (नीला घोल); BaCl 2 + H 2 SO 4 = BaSO 4 + 2HCl (सफेद अवक्षेप)।
तनु सल्फ्यूरिक एसिड कालिख और NaCl के साथ क्रिया नहीं करता है।
4 . प्रत्येक पदार्थ की थोड़ी मात्रा पानी में डालें:
| CuSO 4 +5H 2 O = CuSO 4 5H 2 O | (एक नीला घोल और क्रिस्टल बनते हैं); |
| अल 2 एस 3 + 6 एच 2 ओ = 2 अल (ओएच) 3 + 3 एच 2 एस | (एक अवक्षेप बनता है और एक अप्रिय गंध वाली गैस निकलती है); |
| AlCl 3 + 6H 2 O = A1C1 3 6H 2 O + Q AlCl 3 + H 2 O AlOHCl 2 + HCl अलओएचसी1 2 + एच 2 0 = अल (ओएच) 2 सीएल + एचसीएल ए1(ओएच) 2 सी1 + एच 2 ओ = ए1(ओएच) 2 + एचसीएल |
(एक हिंसक प्रतिक्रिया होती है, मूल लवण और एल्यूमीनियम हाइड्रॉक्साइड के अवक्षेप बनते हैं); |
| पी 2 ओ 5 + एच 2 ओ = 2 एचपीओ 3 एचपीओ 3 +एच 2 ओ = एच 3 पीओ 4 |
(बड़ी मात्रा में ऊष्मा निकलने के साथ एक हिंसक प्रतिक्रिया से एक पारदर्शी घोल बनता है)। |
दो पदार्थ - सोडियम क्लोराइड और अमोनियम क्लोराइड - पानी के साथ प्रतिक्रिया किए बिना घुल जाते हैं; उन्हें सूखे लवण (बिना अवशेष के अमोनियम क्लोराइड सबलाइम) को गर्म करके अलग किया जा सकता है: एनएच 4 सीएल एनएच 3 + एचसीएल; या इन लवणों के घोल से लौ के रंग से (सोडियम यौगिक लौ को पीला रंग देते हैं)।
5. आइए संकेतित अभिकर्मकों की जोड़ीवार अंतःक्रियाओं की एक तालिका बनाएं
| पदार्थों | 1.NaOH | 2 एचसीएल | 3. के 2 सीओ 3 | 4. अल 2 (एसओ 4) 3 | सामान्य अवलोकन परिणाम |
| 1, NaOH | - | - | अल(OH) 3 | 1 तलछट | |
| 2. एनएस1 | _ | सीओ 2 | __ | 1 गैस | |
| 3. के 2 सीओ 3 | - | सीओ 2 | अल(OH) 3 सीओ 2 |
1 तलछट और 2 गैसें | |
| 4. अल 2 (स0 4) 3 | ए1(ओएच) 3 | - | ए1(ओएच) 3 सीओ 2 |
2 तलछट और 1 गैस | |
| NaOH + HCl = NaCl + H2O | |||||
| के 2 सीओ 3 + 2एचसी1 = 2केएस1 + एच 2 ओ + सीओ 2 | |||||
3K 2 CO 3 + Al 2 (SO 4) 3 + 3H 2 O = 2 Al (OH) 3 + 3CO 2 + 3K 2 SO 4;
प्रस्तुत तालिका के आधार पर, सभी पदार्थों को वर्षा की संख्या और गैस विकास द्वारा निर्धारित किया जा सकता है।
6.
सभी घोलों को जोड़े में मिलाया जाता है। घोल का एक जोड़ा जो रास्पबेरी रंग देता है वह NaOH और फिनोलफथेलिन है। रास्पबेरी घोल को दो शेष परीक्षण ट्यूबों में जोड़ा जाता है। जहां रंग गायब हो जाता है वहां सल्फ्यूरिक एसिड होता है, दूसरे में सोडियम सल्फेट होता है। यह NaOH और फिनोलफथेलिन (टेस्ट ट्यूब 1 और 2) के बीच अंतर करना बाकी है।
A. टेस्ट ट्यूब 1 से, घोल 2 की एक बड़ी मात्रा में घोल की एक बूंद डालें।
बी. टेस्ट ट्यूब 2 से, घोल की एक बूंद को बड़ी मात्रा में घोल 1 में मिलाया जाता है। दोनों ही मामलों में, रंग लाल होता है।
घोल ए और बी में सल्फ्यूरिक एसिड घोल की 2 बूंदें मिलाएं। जहां रंग गायब हो जाता है, वहां NaOH की एक बूंद समाहित थी। (यदि घोल ए में रंग गायब हो जाता है, तो NaOH - टेस्ट ट्यूब 1 में)।
| पदार्थों | फ़े | Zn | सीएसीओ 3 | के 2 सीओ 3 | Na2SO4 | सोडियम क्लोराइड | NaNO3 |
| बा(ओएच) 2 | तलछट | तलछट | समाधान | समाधान | |||
| NaOH | हाइड्रोजन का विकास संभव | समाधान | समाधान | समाधान | समाधान | ||
| Ba(OH) 2 में दो लवणों के मामले में और NaOH में चार लवणों के मामले में कोई अवक्षेप नहीं है | डार्क पाउडर (क्षार-घुलनशील - Zn, क्षार-अघुलनशील - Fe) | सीएसीओ 3 दोनों क्षारों के साथ एक अवक्षेप देता है |
एक अवक्षेप दो, लौ के रंग में भिन्नता: K + - बैंगनी, Na + - पीला |
वर्षा नहीं होती; गर्म करने पर व्यवहार में भिन्नता होती है (NaNO 3 पिघलता है और फिर विघटित होकर O 2 छोड़ता है, फिर NO 2 | |||
8 . पानी के साथ हिंसक प्रतिक्रिया करें: पी 2 ओ 5 और सीएओ क्रमशः एच 3 पीओ 4 और सीए (ओएच) 2 के गठन के साथ:
पी 2 ओ 5 + 3 एच 2 ओ = 2 एच 3 पीओ 4, सीएओ + एच 2 ओ = सीए (ओएच) 2।
पदार्थ (3) और (4) - Pb(NO 3) 2 और CaCl 2 - पानी में घुल जाते हैं। समाधान एक दूसरे के साथ इस प्रकार प्रतिक्रिया कर सकते हैं:
| पदार्थों | 1. एन 3 आरओ 4 | 2. सीए(ओएच) 2, | 3. Pb(NO 3) 2 | 4.CaCl2 |
| 1. एन 3 आरओ 4 | CaHPO 4 | PbHPO4 | CaHPO 4 | |
| 2. Ca(OH) 2 | सैनरो 4 | पीबी(ओएच)2 | - | |
| 3. Pb(NO 3) 2 | पीबीएनपीओ 4 | पीबी(ओएच)2 | РbСl 2 | |
| 4. CaC1 2 | CaHPO 4 | PbCl2 |
इस प्रकार, समाधान 1 (एच 3 पीओ 4) अन्य सभी समाधानों के साथ परस्पर क्रिया करने पर अवक्षेपित होता है। समाधान 3 - Pb(NO 3) 2 भी अन्य सभी समाधानों के साथ अवक्षेप बनाता है। पदार्थ: I -P 2 O 5, II -CaO, III -Pb(NO 3) 2, IV-CaCl 2।
सामान्य तौर पर, अधिकांश वर्षा की घटना उस क्रम पर निर्भर करेगी जिसमें समाधान निकाला जाता है और उनमें से एक की अधिकता (एच 3 पीओ 4 की एक बड़ी अधिकता में, सीसा और कैल्शियम फॉस्फेट घुलनशील होते हैं)।
9.
समस्या के कई समाधान हैं, जिनमें से दो नीचे दिए गए हैं।
एक।सभी परखनलियों में कॉपर सल्फेट घोल डालें:
2NaOH + CuSO 4 = Na 2 SO 4 + Cu(OH) 2 (नीला अवक्षेप);
Na 2 S + CuSO 4 = Na 2 SO 4 + CuS (काला अवक्षेप);
NaCl + CuSO 4 (पतले घोल में कोई परिवर्तन नहीं);
4NaI+2CuSO 4 = 2Na 2 SO 4 + 2CuI+I 2 (भूरा अवक्षेप);
4NH 3 + CuSO 4 = Cu(NH 3) 4 SO 4 (नीला घोल या नीला अवक्षेप, अतिरिक्त अमोनिया घोल में घुलनशील)।
बी।सभी परखनलियों में सिल्वर नाइट्रेट घोल डालें:
2NaOH + 2AgNO 3 = 2NaNO 3 + H 2 O + Ag 2 O (भूरा अवक्षेप);
Na 2 S + 2AgNO 3 = 2NaNO 3 + Ag 2 S (काला अवक्षेप);
NaCl + AgNO 3 = NaN0 3 + AgCl (सफेद अवक्षेप);
NaI + AgNO 3 = NaNO 3 + AgI (पीला अवक्षेप);
2NH 3 + 2AgNO 3 + H 2 O = 2NH 4 NO 3 + Ag 2 O (भूरा अवक्षेप)।
Ag 2 O अतिरिक्त अमोनिया घोल में घुल जाता है: Ag 2 0 + 4NH 3 + H 2 O = 2OH।
10 . इन पदार्थों को पहचानने के लिए, सभी समाधानों को एक दूसरे के साथ प्रतिक्रिया करनी चाहिए:
| पदार्थों | 1. NaCl | 2.NH4C1 | 3. बा(OH), | 4. NaOH | सामान्य अवलोकन परिणाम |
| 1. NaCl | ___ | _ | _ | कोई इंटरैक्शन नहीं देखा गया | |
| 2.NH4Cl | _ | एक्स | एनएच 3 | एनएच 3 | दो मामलों में गैस निकलती है |
| 3. बा(OH) 2 | - | एनएच 3 | एक्स | - | |
| 4. NaOH | - | एनएच 3 | - | एक्स | एक मामले में गैस निकलती है |
NaOH और Ba(OH) 2 को उनके अलग-अलग लौ रंगों से पहचाना जा सकता है (Na+ पीला है, और Ba 2+ हरा है)।
11. संकेतक पेपर का उपयोग करके समाधान की अम्लता निर्धारित करें:
1) अम्लीय वातावरण -एचसीएल, एनएच 4 सी1, पीबी(एनओ 3) 2;
2) तटस्थ माध्यम - Na 2 SO 4, BaCl 2, AgNO 3;
3) क्षारीय वातावरण - Na 2 CO 3, NaOH। आइए एक टेबल बनाएं.
लक्ष्य: विशिष्ट (गुणात्मक) प्रतिक्रियाओं का उपयोग करके कार्बनिक पदार्थों को पहचानने में कौशल विकसित करना, पदार्थों के गुणों और उत्पादन के लिए प्रतिक्रिया समीकरण तैयार करने में कौशल को समेकित करना, प्रयोगात्मक समस्याओं को हल करना।
समय सीमा: 2 घंटे
सैद्धांतिक सामग्री
लगभग हर कार्बनिक पदार्थ को विशिष्ट प्रतिक्रियाओं का उपयोग करके निर्धारित किया जा सकता है। इन प्रतिक्रियाओं को गुणात्मक कहा जाता है।
किसी कार्बनिक पदार्थ का यौगिकों के कुछ वर्गों से संबंध, उनकी संरचना और शुद्धता की डिग्री को मौलिक और कार्यात्मक विश्लेषण का उपयोग करके स्थापित किया जाता है। गुणात्मक तात्विक विश्लेषण किसी कार्बनिक यौगिक के अणुओं की गुणात्मक संरचना निर्धारित करने की अनुमति देता है; मात्रात्मक तात्विक विश्लेषण किसी यौगिक की तात्विक संरचना और उसके सरलतम सूत्र को स्थापित करता है।
यदि प्रतिसंश्लेषण किया जाए तो कार्बनिक यौगिक की संरचना को निर्णायक रूप से सिद्ध माना जा सकता है; एक व्यवस्थित रासायनिक विश्लेषण किया गया, जिसमें शामिल हैं: प्रारंभिक परीक्षण, कार्यात्मक और गैर-कार्यात्मक समूहों के लिए गुणात्मक प्रतिक्रियाएं, विभिन्न व्युत्पन्न प्राप्त किए गए; वर्णक्रमीय विश्लेषण विधियाँ अपनाई गईं।
परिणामस्वरूप, मुख्य पहचान कार्य करने से पहले, जिसमें एक बहुक्रियाशील कार्बनिक पदार्थ की संरचना का निर्धारण करना या बाइनरी मिश्रण के घटकों की पहचान करना शामिल है, कार्यात्मक समूहों (गुणात्मक प्रतिक्रियाओं, आईआर में विशेषता अवशोषण आवृत्तियों) का पता लगाने के लिए तरीकों को विकसित करने की सलाह दी जाती है। स्पेक्ट्रा, यूवी और एनएमआर स्पेक्ट्रा), कार्बनिक यौगिकों (अल्कोहल, फिनोल, एल्डिहाइड या केटोन्स, कार्बोक्जिलिक एसिड और एमाइन) के पांच सबसे महत्वपूर्ण वर्गों में से प्रत्येक के कार्यात्मक डेरिवेटिव को प्राप्त करना और शुद्ध करना।
कार्बनिक पदार्थों का कार्यात्मक विश्लेषण और पहचान प्रारंभिक परीक्षणों से शुरू होती है, जिसमें शामिल हैं: भौतिक स्थिरांक का निर्धारण, दहन परीक्षण, पानी और कार्बनिक सॉल्वैंट्स में घुलनशीलता, गुणात्मक विश्लेषण। कार्बनिक पदार्थों के वर्गों से संबंधित होने का निर्धारण अभिकर्मकों के साथ उनके संबंध से किया जा सकता है
अनुभव क्रमांक 1.ग्लूकोज एक एल्डिहाइड अल्कोहल है
कॉपर हाइड्रॉक्साइड की थोड़ी मात्रा प्राप्त करें। परिणामी तलछट में 2-3 मिलीलीटर जोड़ें। ग्लूकोज समाधान. परखनली को तब तक हिलाएं जब तक अवक्षेप घुल न जाए और चमकीला नीला घोल प्राप्त न हो जाए। यह किस बात का प्रमाण है? तरल के ऊपरी भाग को स्पिरिट लैंप की लौ में तब तक सावधानी से गर्म करें जब तक कि उसमें उबाल न आने लगे। नीले रंग के हरे, पीले, लाल और फिर भूरे अवक्षेप में परिवर्तन का निरीक्षण करें। उसकी शक्ल का क्या मतलब है? ग्लूकोज की पहचान और यह क्या है, इसके बारे में निष्कर्ष निकालें। प्रतिक्रिया समीकरण लिखें.
अनुभव क्रमांक 2."सिल्वर मिरर" प्रतिक्रिया
एक साफ टेस्ट ट्यूब में 2 मिलीलीटर डालें। सिल्वर नाइट्रेट के अमोनिया घोल में ग्लूकोज घोल की 5-10 बूंदें मिलाएं। मिश्रण को धीरे-धीरे गर्म करें। अवलोकन, प्रतिक्रिया समीकरण लिखें। ग्लूकोज पहचान के बारे में निष्कर्ष निकालें। इस प्रतिक्रिया को "सिल्वर मिरर" प्रतिक्रिया क्यों कहा जाता है?
अनुभव क्रमांक 3.सुक्रोज
क) एक परखनली में कॉपर हाइड्रॉक्साइड अवक्षेप प्राप्त करें। इसमें चीनी का घोल डालें और हिलाएं. तलछट का क्या हुआ? क्यों? सुक्रोज की संरचना क्या है? गर्मी। क्या भूरे रंग का तलछट बन रहा है? एक निष्कर्ष निकालो।
ख) एक परखनली में थोड़ा सा चीनी का घोल डालें, सल्फ्यूरिक एसिड की एक बूंद डालें और उबालें।
सल्फ्यूरिक एसिड के साथ सुक्रोज के जलीय घोल की प्रतिक्रिया के लिए समीकरण लिखें। इस प्रतिक्रिया को क्या कहते हैं?
ग) सुक्रोज से ग्लूकोज के निर्माण को प्रयोगात्मक रूप से सिद्ध करें। ऐसा करने के लिए, अवक्षेप बनने तक घोल में कॉपर सल्फेट और सोडियम हाइड्रॉक्साइड की 2-3 बूंदें मिलाएं। गर्मी। रंग परिवर्तन पर ध्यान दें. एक निष्कर्ष निकालो। सुक्रोज के जल अपघटन के दौरान कौन सा पदार्थ बनता है?
अनुभव क्रमांक 4.स्टार्च
टेस्ट ट्यूब के निचले हिस्से में थोड़ा सा स्टार्च डालें, थोड़ा ठंडा पानी डालें, हिलाएं और गर्म पानी के साथ दूसरी टेस्ट ट्यूब में डालें। स्टार्च पेस्ट बनने तक उबालें।
परखनली में आयोडीन का थोड़ा सा अल्कोहल घोल डालें। क्या देखा जा रहा है? स्टार्च की पहचान के बारे में निष्कर्ष निकालें।
अनुभव क्रमांक 5.स्टार्च हाइड्रोलिसिस
नीले स्टार्च पेस्ट के घोल में सल्फ्यूरिक एसिड की 1-3 बूंदें मिलाएं। घोल को तब तक उबालें जब तक नीला रंग गायब न हो जाए। नीला रंग क्यों गायब हो गया? स्टार्च का क्या हुआ? प्रतिक्रिया के परिणामस्वरूप कौन सा पदार्थ बना? प्रतिक्रिया समीकरण लिखें. एक निष्कर्ष निकालो।
प्रायोगिक भाग
विशिष्ट प्रतिक्रियाओं का उपयोग करके पदार्थों को पहचानें, प्रतिक्रिया समीकरण लिखें और स्थितियों को इंगित करें।
1 विकल्प
1. एक अभिकर्मक का उपयोग करके ग्लूकोज और ग्लिसरॉल निर्धारित करें। प्रतिक्रिया समीकरण लिखिए
विकल्प 2
1. टेस्ट ट्यूब में सुक्रोज और ग्लूकोज होता है। एक अभिकर्मक का उपयोग करके प्रत्येक पदार्थ का निर्धारण करें और प्रतिक्रिया समीकरण लिखें।
विकल्प 3
1. प्रयोगात्मक रूप से सिद्ध करें कि ग्लूकोज एक एल्डिहाइड अल्कोहल है। प्रतिक्रिया समीकरण लिखें.
विकल्प 4
1. एक अभिकर्मक का उपयोग करके ग्लिसरॉल और एल्डिहाइड निर्धारित करें। प्रतिक्रिया समीकरण लिखें.
विकल्प 5
1. दिए गए समाधानों की पहचान करें: एथिल अल्कोहल और ग्लिसरीन। प्रतिक्रिया समीकरण लिखें.
नियंत्रण प्रश्न:
1. किन प्रतिक्रियाओं को गुणात्मक कहा जाता है?
2. कार्यात्मक समूह क्या है?
3. अल्कोहल, एल्डिहाइड, एसिड के कार्यात्मक समूह क्या हैं?
प्रयोगशाला पाठ संख्या 4
अभ्यास 1
दो बिना लेबल वाली टेस्ट ट्यूबों में निम्नलिखित पदार्थ होते हैं:
विकल्प 1:एथिल अल्कोहल और फॉर्मिक एसिड;
विकल्प 2:ग्लूकोज और ग्लिसरीन के समाधान;
विकल्प 3:फॉर्मेल्डिहाइड और प्रोटीन के समाधान;
विकल्प 4:वनस्पति और मशीन तेल;
विकल्प 5:स्टार्च पेस्ट और ग्लिसरीन;
विकल्प 6:ग्लूकोज और इथेनॉल समाधान;
विकल्प 7:सुक्रोज और ग्लूकोज के समाधान.
अपने विकल्प संख्या के अनुसार अपने शिक्षक से दो टेस्ट ट्यूब प्राप्त करें। प्रत्येक टेस्ट ट्यूब की सामग्री को प्रयोगात्मक रूप से निर्धारित करने के लिए एक विधि सुझाएं। आपके शिक्षक द्वारा आपके प्रस्ताव को मंजूरी देने के बाद, व्यावहारिक पदार्थ पहचान के लिए आगे बढ़ें।
कार्य 2
एक अभिकर्मक का उपयोग करके साबित करें कि ग्लूकोज दोहरे कार्य वाला एक पदार्थ है।
कार्य 3
आपको समाधान के साथ टेस्ट ट्यूब दिए जाते हैं, जिनमें से एक में ग्लिसरीन होता है, दूसरे में फॉर्मेल्डिहाइड होता है, और तीसरे में ग्लूकोज होता है। समान अभिकर्मकों का उपयोग करके, प्रत्येक पदार्थ की पहचान करें।
कार्य 4
प्रयोगात्मक रूप से साबित करें कि आलू और सफेद ब्रेड में स्टार्च होता है, और पके सेब में ग्लूकोज होता है।
व्यावहारिक कार्य क्रमांक 2
प्लास्टिक और फाइबर की पहचान
अभ्यास 1
आपको निम्नलिखित सूची से दो प्लास्टिक के नमूने पेश किए जाते हैं: पॉलीथीन, पॉलीविनाइल क्लोराइड, फेनोलिक। तालिका 10 का उपयोग करके, निर्धारित करें कि आपको कौन सा प्लास्टिक दिया गया था। आपको दिए गए प्लास्टिक की संरचनात्मक इकाइयों के सूत्र लिखें।
तालिका 10 प्लास्टिक के गुण
कार्य 2
आपको निम्नलिखित सूची में से तीन रेशों के नमूने - धागा या कपड़ा - पेश किए जाते हैं: कपास, ऊन, प्राकृतिक रेशम, विस्कोस फाइबर, एसीटेट फाइबर, नायलॉन। तालिका 11 का उपयोग करके, निर्धारित करें कि आपको कौन से फाइबर दिए गए थे।
तालिका 11
फाइबर गुण

समस्या 10
एक फार्मास्युटिकल उद्यम की विश्लेषणात्मक प्रयोगशाला को निम्नलिखित रासायनिक संरचना वाले औषधीय पदार्थ के समाधान के साथ ampoules और शीशियाँ प्राप्त हुईं और "विवरण" अनुभाग के तहत एनडी की आवश्यकताओं को पूरा नहीं किया गया - समाधान का पीलापन देखा गया।
खुराक प्रपत्र की तैयारी के दौरान दवा पदार्थ में संभावित परिवर्तनों का औचित्य बताएं।
दवा का रूसी, लैटिन और तर्कसंगत नाम बताएं। भौतिक-रासायनिक गुणों (उपस्थिति, घुलनशीलता, वर्णक्रमीय और ऑप्टिकल विशेषताओं) और गुणवत्ता मूल्यांकन में उनके उपयोग का वर्णन करें।
रासायनिक गुणों के अनुसार पहचान प्रतिक्रियाओं और मात्रा निर्धारण के तरीकों का सुझाव दें। प्रतिक्रिया समीकरण लिखें.
कार्बोहाइड्रेट
कार्बोहाइड्रेट प्राकृतिक पदार्थों का एक बड़ा समूह बनाते हैं जो पौधों और जानवरों के जीवों में विभिन्न कार्य करते हैं। कार्बोहाइड्रेट मुख्य रूप से पौधों के स्रोतों से प्राप्त होते हैं।
इस समूह की सबसे महत्वपूर्ण दवा ग्लूकोज है। सुक्रोज और स्टार्च थोड़ा कम।
कार्बोहाइड्रेट समूह से औषधीय पदार्थों के गुण। 
एक औषधीय उत्पाद के रूप में ग्लूकोज की गुणवत्ता के लिए एनडी आवश्यकताएं रासायनिक रूप से शुद्ध पदार्थों की आवश्यकताओं के अनुरूप हैं। ग्लूकोज के विशिष्ट भौतिक गुण ध्रुवीकरण के विमान के एक स्पष्ट रोटेशन (10% ग्लूकोज समाधान +52.3 डिग्री का विशिष्ट रोटेशन), निर्जल ग्लूकोज के टी पीएल के साथ ऑप्टिकल गतिविधि हैं।
ग्लूकोज के लिए, जो मोनोहाइड्रेट के रूप में प्राप्त होता है, क्रिस्टलीकरण के पानी की मात्रा दवा की गुणवत्ता का संकेतक है। क्रिस्टलीकरण के पानी की मात्रा ग्लूकोज मोनोहाइड्रेट के वजन से 10% होनी चाहिए।
ताजा तैयार ग्लूकोज समाधान में, उत्परिवर्तन होता है (समय के साथ घूर्णन कोण में परिवर्तन)।
ग्लूकोज घोल में अमोनिया घोल (0.1% से अधिक नहीं) मिलाकर उत्परिवर्तन को तेज किया जा सकता है।
α-D-ग्लूकोज़ के लिए, घूर्णन कोण +109.6° है, और β-D-ग्लूकोज़ के लिए +20.5° है।

रासायनिक गुण
ग्लूकोज एक मोनोसैकेराइड है, सुक्रोज एक ऑलिगोसैकेराइड है, स्टार्च एक पॉलीसैकेराइड है। मोनोसैकेराइड, दोहरे कार्य वाले पदार्थ, अल्कोहल और एल्डिहाइड। ओलिगोसैकेराइड और पॉलीसैकेराइड हाइड्रोलिसिस से मोनोसैकेराइड में परिवर्तित हो जाते हैं।
अल्कोहल हाइड्रॉक्सिल पर प्रतिक्रियाएँ
पॉलीहाइड्रिक अल्कोहल के रूप में, ग्लूकोज, सुक्रोज (जैसे एथिलीन ग्लाइकॉल और ग्लिसरॉल) कॉपर (II.) हाइड्रॉक्साइड के साथ प्रतिक्रिया करके नीले जटिल यौगिक बनाने में सक्षम होते हैं।
कार्बोहाइड्रेट समूह की दवाएं भी एस्टरीफिकेशन प्रतिक्रियाओं में सक्षम हैं।
एल्डिहाइड समूह पर प्रतिक्रियाएँ
ऑक्सीकरण.
ऑक्सीकरण स्थितियों के आधार पर, मोनोसेकेराइड विभिन्न उत्पादों में परिवर्तित हो जाते हैं। क्षारीय वातावरण में, मोनोसेकेराइड टोलेंस और फेहलिंग अभिकर्मकों जैसे हल्के ऑक्सीकरण एजेंटों के प्रभाव में ऑक्सीकरण होते हैं)। टॉलेंस का अभिकर्मक "सिल्वर मिरर" प्रतिक्रिया से गुजरता है, जो एल्डिहाइड की विशेषता है। नतीजतन, मोनोसेकेराइड अपने खुले (एल्डिहाइड) रूप में इस प्रतिक्रिया में प्रवेश करते हैं


फार्मास्युटिकल विश्लेषण में इन प्रतिक्रियाओं का उपयोग करते समय, उनकी संवेदनशीलता को ध्यान में रखा जाना चाहिए। इसके लिए हां इसकी सूचना देने वालाएल्डिहाइड समूह के साथ दवा की प्रामाणिकताएक अणु में, के साथ एक प्रतिक्रिया सिल्वर नाइट्रेट और Fe अभिकर्मक लिंग , और के लिए एल्डिहाइड का पता लगाना अशुद्धियों के रूप मेंऔषधीय तैयारियों में उपयोग किया जाना चाहिए अधिक संवेदनशीलप्रतिक्रिया (नेस्लर के समाधान के साथ)।

ग्लाइकोसाइड और अन्य कार्बोहाइड्रेट डेरिवेटिव जिनमें हेमिसिएटल हाइड्रॉक्सिल नहीं होता है, वे एल्डिहाइड रूप में परिवर्तित नहीं हो सकते हैं और इसलिए उनमें कम करने की क्षमता नहीं होती है और इन अभिकर्मकों के साथ प्रतिक्रिया नहीं करते हैं।
सत्यताजी ल्यूकोस (प्रामाणिकता के परीक्षण के रूप में, एफएस फेहलिंग के अभिकर्मक के साथ ग्लूकोज ऑक्सीकरण की प्रतिक्रिया का उपयोग करता है)।
ग्लूकोज के प्रति अन्य संवेदनशील और विशिष्ट प्रतिक्रियाएं हैं जो एनडी में शामिल नहीं हैं। इस प्रकार, सांद्र सल्फ्यूरिक एसिड की क्रिया के तहत, फ़्यूरफ़्यूरल बनता है, जो किसी भी फिनोल (रिसोरिसिनॉल, थाइमोल, ए-नेफ़थॉल) या सुगंधित अमाइन के साथ, रंगीन प्रतिक्रिया उत्पाद (लाल) बनाता है:

कॉपर (II) सल्फेट के साथ, ग्लूकोज, जब क्षारीकृत होता है (गर्म किए बिना!), एक घुलनशील बैंगनी-नीला कॉम्प्लेक्स बनाता है। इस प्रकार, एल्डिहाइड और अल्कोहल कार्यात्मक समूहों दोनों की उपस्थिति एक साथ सिद्ध होती है।
विशिष्ट घूर्णन की परिभाषा को भी विनियमित किया जाता है.
पवित्रता. ग्लूकोज पर ग्लोबल फंड लेख में शामिल हैंमानक परीक्षण: समाधान की पारदर्शिता और रंग, अम्लता, क्लोराइड, सल्फेट्स, कैल्शियम, बेरियम, डेक्सट्रिन, आर्सेनिक की उपस्थिति। पाइरोजेनिसिटी के लिए इंजेक्शन समाधानों का अतिरिक्त परीक्षण किया जाता है।
परिमाणीकरण .
ग्लोबल फंड मात्रात्मक को विनियमित नहीं करता है पदार्थ की नई परिभाषा. ग्लूकोज की तैयारी में, विशेष रूप से समाधान में इंजेक्शन के लिए, ग्लूकोज को पोलारिमेट्रिक रूप से निर्धारित किया जाता है।
ग्लूकोज तैयारी का मात्रात्मक निर्धारण फॉर्मेल्डिहाइड के सादृश्य पर आधारित है। आयोडीन, हाइड्रोजन पेरोक्साइड और नेस्लर के अभिकर्मक का उपयोग ऑक्सीकरण एजेंट के रूप में किया जा सकता है।

हाइपोआयोडाइट के बनने से फॉर्मेल्डिहाइड ऑक्सीकरण की संभावना पैदा होती है।

फॉर्मेल्डिहाइड के ऑक्सीकरण के बाद, सल्फ्यूरिक एसिड मिलाया जाता है, जो शेष लवण (NaOI, NaOI 3) से आयोडीन और उसके बराबर मात्रा में सोडियम आयोडाइड को विस्थापित कर देता है।
जारी आयोडीन को सोडियम थायोसल्फेट के साथ अनुमापनित किया जाता है। आयोडीन अनुमापन के लिए प्रयुक्त आयोडीन और सोडियम थायोसल्फेट की मात्रा के बीच का अंतर फॉर्मेल्डिहाइड के ऑक्सीकरण के लिए प्रयुक्त आयोडीन की मात्रा के बराबर है।